| 药用植物内生菌对乌苏酸(熊果酸)的微生物转化筛选 |
| 发布时间:2013-01-15 信息来源:admin 发布人:admin 点击次数:3968 |
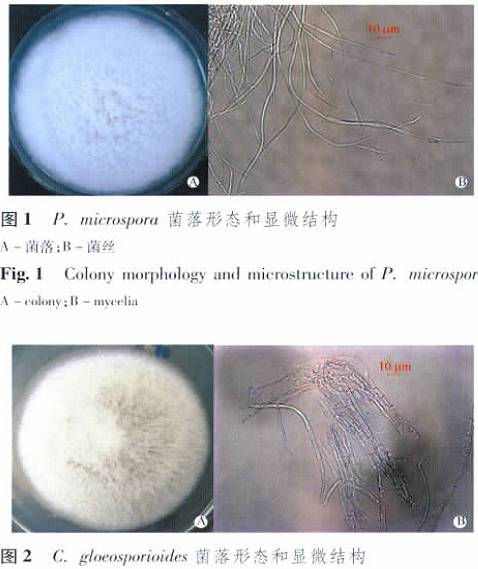
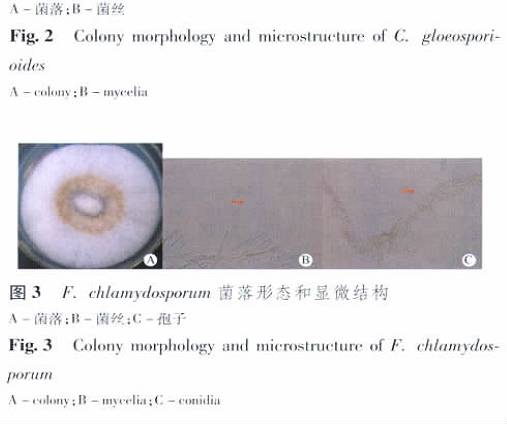
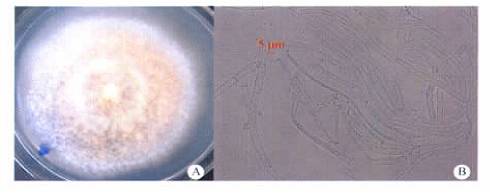
药用植物内生菌对乌苏酸(熊果酸)的微生物转化筛选 付少彬, 杨峻山,崔晋龙, 孙迪安* ( 中国医学科学院北京协和医学院药用植物研究所, 北京 100193) 摘要:目的 从药用植物蛇足石杉分离纯化内生菌,并筛选可以转化乌苏酸的菌株, 以期探究利用药用植物内生菌对乌苏酸 进行结构修饰和改造的可行性 方法 通过组织块法分离内生菌; 用薄层色谱检测转化反应的发生; 用 CTAB 法提取转化菌 株的基因组 DNA, PCR 技术对其 ITS rDNA 进行扩增, 再经 Blast 比对鉴定菌株 结果 从药用植物蛇足石杉的茎和叶中分离 得到内生菌52 株, 用30 株对乌苏酸进行转化筛选 有4 株内生菌具有转化乌苏酸的能力,经表观形态及分子生物学的方法 鉴定转化菌株, 分别是 Pestalotiopsis microspora, Colletotrichum gloeosporioides, Fusarium chlamydosporum, Arthrinium. sp 结论 从 转化产物的结构可以得出结论, 利用药用植物内生菌对天然活性成分乌苏酸进行微生物转化, 可以丰富乌苏酸的结构类型, 为获得活性更好的衍生物提供技术和方法基础 关键词:药用植物;蛇足石杉;内生菌;微生物转化;乌苏酸;筛选 中图分类号: R284 文献标志码: A 文章编号: 1001 - 2494( 2011) 16 - 1225 - 04 Screening of Endophytic Fungi from Medicinal Plant for Microbial Transformation of Ursolic Acid FU Shao- bin, YANG Jun- shan, CUI Jin- long, SUN Di- an* ( Institute of Medical Plant Development, Chinese Academy of Medi- cal Sciences and Peking Union Medical College, Beijing 100193, China) ABSTRACT: OBJECTIVE To isolate and purify endophytes from medicinal plant Huperzia serrata and to screen the strains which can modify the structure of ursolic acid. METHODS Endophytes were isolated and purified by tissue segments, and the microbial transformation reactions of ursolic acid were identified by thin- layer chromatography ( TLC) ; the genomic DNA of transformation strains were extracted with CTAB method and amplified by PCR, and then compared by blast. RESULTS 52 Endophytes were obtained from the stems and leaves of medicinal plant H. serrata; 30 endophytes were screened, among which 4 could microbially transform ursolic acid. The transformation strains were indentified as Pestalotiopsis microspora, Colletotrichum gloeosporioides, Fusarium chlamydosporum, Arthrinium. Sp based on the morphological characteristics and ITS rDNA sequences. CONCLUSION Through the structures of the biotransformation products we can conclude that the microbial transformation of ursolic acid by enophytic fungi strains from H. serrata can diversify the structure of ursolic acid. The work in this paper paved the technical and methodological way for biotransformation of natural compound by endophytic fungi from medicinal plants to obtain derivatives with better activities. KEY WORDS: medicinal plant; Huperzia serrata; endophytes; microbial transformation; ursolic acid; screening 20 世纪末期内生菌受到微生物学家植物学家 药学家 微生态学家以及农业科学家 植物保护工作人员的广泛关注,成为植物微生物学学科发展的一次革命, 目前内生菌的研究已成为多个学科交叉的新的生长点,也是当前国内外很多研究领域的热点[1- 2] 内生真菌在药用植物界分布广泛,普遍存在各种药用植物中, 而且几乎每种植物都有内生菌据统计,近十多年来, 人们从47 科81 属114 种3 变种药用植物中分离到的内生真菌就达到 171 属, 涉及到了子囊菌担子菌 接合菌 卵菌以及很多不产孢的类群[3] 药用植物内生菌一方面可以产生多种活性成分,包括抗肿瘤活性成分紫杉醇类[4- 5], 抗菌活性物质[6- 7], 另一方面还可以促进宿主植物产生更多的活性物质[8- 9], 此外还有抗生素物质[10], 抗糖尿病成分[11]等 所以利用药用植物内生菌筛选活性成分或新型化合物以创造新药,可以很大程度缓解药用植物资源短缺的问题乌苏酸是一种 -香树脂型五环三萜, 它在自然界分布很广, 存在多种植物中, 如存在于杜鹃花科植物熊果的叶果实中, 玄参科植物毛泡桐的叶中, 以及木樨科植物女贞的叶中等 药理学研究表明, 乌苏酸具有多种生物活性, 如乌苏酸及其衍生物具有抗肿瘤活性[12- 13], 抗炎抗菌活性[14], 抗HIV 活性[15], 保肝护肝作用[16]等, 具有很好的开发价值为进一步增强乌苏酸的药理活性, 提高其生物利用度,对乌苏酸进行结构修饰和改造引起大家普遍关注 但是利用药用植物内生菌通过微生物转化的方法对其进行结构修饰笔者还未见报道本实验从药用植物蛇足石杉中分离内生菌, 筛选具有转化乌苏酸能力的菌株,为以后进一步研究提供基础1 材料和方法 1 材料和方法 1. 1 内生菌的分离与纯化 取健康蛇足石杉( 材料于2008 年采自贵州和重庆, 经中国医学科学院药用植物研究所孙迪安究员鉴定) 的茎和叶子, 在自来水下冲洗 2 h, 然后在超净工作台中用无菌水洗涤 10 次后, 茎用体积分数75%乙醇浸泡3 ~ 4 min, 0. 1%升汞浸泡 15 min, 而叶子则用体积分数75%乙醇浸泡1 min, 0. 1%升汞浸泡消毒10 min, 以达到表面消毒杀菌的目的,茎和叶再用无菌水洗涤5 次后切成小块置于 PDA 平板,室温黑暗培养 最后1 次洗涤的无菌水作为对照置于同样条件培养 待组织切块周围长出菌丝时, 挑取菌丝尖端转入 PDA 平板进行纯化, 最后接入 PDA斜面上置于4 ℃冰箱保存备用 1. 2 培养基 马铃薯去皮 200 g 切块加蒸馏水煮沸 20 min,纱布过滤得滤液, 蒸馏水定容至 1 L, 加 20 g 葡萄糖, 固体培养基加入琼脂20 g, 液体则不加, 121 ℃,高温灭菌25 min, 制成 PDA 平板 斜面以及液体培养基备用1. 3 底物乌苏酸底物( 长沙上禾生物科技发展有限公司) , 通过与文献[17]对比其1H- NMR, 13C- NMR, 确定为乌苏酸 1. 4 乌苏酸的微生物转化筛选 取已经纯化的菌株于超净工作台上接种至已灭菌的100 mL 三角瓶的 PDB 液体培养基中( 内装 40mL 培养基) , 28 ℃ 160 r min - 1恒温振荡培养, 2 ~3 d 后, 加入 0. 5 mg 乌苏酸( 用乙醇溶解) , 相同条件下继续培养10 d 同时2 个对照组在相同条件培养, 1 个底物对照组: 培养基中不接种微生物但等量的底物, 另1 个菌株对照组: 培养基中接种 物加入等体积的乙醇溶液( 无底物) 待发酵完后用等体积的乙酸乙酯超声萃取 40 min, 减压至小体积, 薄层色谱( TLC) 检测转化反应是否发TLC 展开剂的条件: 石油醚-丙酮-乙酸( 3∶ 2∶ 0. 1及氯仿-甲醇( 12∶ 1) 放大发酵培养用于转化产的分离, 采用柱色谱及高效液相的方法, 而转化的鉴定借助波谱学的手段完成 1. 5 转化菌种的鉴定 对具有转化乌苏酸能力的菌株用 CTAB 法提取核糖体( rDNA) , 选用通用引物 ITS1 ( 5- TCC GTAGGT GAA CCT GCG G- 3) 和 ITS4 ( 5- TCC TCCGCT TAT TGA TAT GC- 3) 对ITS 区进行PCR 扩增,程序如下: 94 ℃预变性3 min; 94 ℃变性30 s,55 ℃复性30 s 以及72 ℃ 延伸1 min, 共进行30 个循环; 72 ℃后延伸 10 min, 再经过 NCBI 网站的Blast, 结合菌落形态及显微观察, 鉴定内生菌的种类 2 结果与结论 从药用植物蛇足石杉的茎和叶中分离得到内生真菌52 株, 任选其中 30 株用于乌苏酸的微生物转化筛选, 经 TLC 检测,共有 4 株可以转化乌苏酸其中 3 株从茎中分离得到, 1 株从叶子分离得到经过对转化菌种的表观形态及 ITS rDNA 的 PCR 扩增及 Blast 比对, 这4 株真菌属于不同的属,分别鉴定为 Pestalotiopsis microspora ( 相似度100%) , Colle-totrichum gloeosporioides ( 相似度 100%) , Fusariumchlamydosporum ( 相似度 99%) , Arthrinium. sp ( 相似度99%) 2. 1 菌株鉴定 P. microspora 从蛇足石杉的茎中分离得到, 新鲜标本采自重庆 菌落形态及显微结构见图1 在 PDA 培养基上黑暗培养, 菌丝生长较快, 6 d后菌落直径达7. 1 ~ 7. 6 cm 菌落平坦, 边缘整齐菌丝无色或接近无色该菌株的 ITS rDNA 序列长为511 bp, Blast 比对结果为, 与序列 P. microspora( GU441597. 1) 的相似性为 100% 结合菌落特征及孢子形态, 把该菌株定为 P. microsporaC. gloeosporioides 从蛇足石杉的茎中分离得到,新鲜标本采自贵阳 菌落形态及显微结构见图2菌丝生长较快, 在 PDA 培养基上黑暗培养6 d,菌落直径可达 5. 9 ~ 6. 2 cm 左右 菌落灰白色, 气生菌丝非常发达, 呈直立毛状, 背面黑色或略带褐 色 气生菌丝无色至淡褐色,有隔 该菌株 ITS rD-NA 序列为 495 bp, 经 Blast 对比结果与序列 C.gloeosporioides ( HM034808. 1) 相似性为 100% 通过表型与基因型的综合分析, 该菌株定为 C. gloeos-porioidesF. chlamydosporum 从蛇足石杉的茎中分离得到,新鲜标本采自贵阳 菌落形态及显微结构见图3菌丝生长快, 在 PDA 培养基上黑暗培养6 d, 菌 落直径可达 7. 2 ~ 7. 8 cm菌落开始为白色, 后变成黄褐色, 背面可见黄褐
色 气生菌丝通常发达,致密的丛毛状 分生孢子梗初产生于气生菌丝时不分枝或分枝的单一瓶梗状或多瓶梗状分生孢子无色光滑, 小型分生孢子多为单细胞, 卵圆形, 大小( 9 ~ 11) × ( 2 ~ 3) m; 大型分生孢子镰刀形, 稍弯曲,( 31 ~ 34) × ( 2. 5 ~ 3. 5)m 该菌株的 ITS rDNA 序列为491 bp, 经 Blast 比对, 结果与序列 F. chlamydosporum ( HQ671187. 1)相似性为99%, 结合形态学特征, 我们把该菌株鉴定为 F. chlamydosporum Arthrinium. sp 从蛇足石杉的叶中分离得到, 新鲜标本采自贵阳 菌落形态及显微结构见图4在 PDA 培养基上黑暗培养,生长较缓慢, 6 d 后菌落直径达 2. 1 ~ 2. 5 cm 菌落不平坦, 菌丝体初为白色, 后渐变为粉色或黄色, 呈毡状, 边缘整齐气生菌丝发达, 接近无色, 约1. 8 ~ 3. 5 m 该菌株的 ITS rDNA 序列长为554 bp, 经 Blast 比对, 结果与 序列 Arthrinium. sp( HQ630985. 1) 相似性为 99%但是通过形态学和 ITS 的分析, 该菌株我们只能鉴定到属, 有待进一步研究 2. 2 转化反应的检测 经 TLC 方法( 展开剂,石油醚-丙酮-冰醋酸 = 3∶2∶ 0. 01) 检测内生菌是否具有转化乌苏酸的能力其结果见图 5 转化粗提物中比菌对照中多出的点, 这些点我们初步判断其是转化产物 底物经硫酸乙醇显色后为紫红色,而转化产物也多为红色 粉红色 橘黄色等, 也辅助我们辨别转化反应的发生 2. 3 转化产物的多样性 转化产物经柱色谱和高效液相分离得到, 经1D和2D NMR 及质谱数据推导转化产物的结构( 待发表) , 有 3- oxo- 15 , 30- dihydroxy - urs- 12- en- 28- oicac-id, 3 , 15 - dihydroxy- urs- 12- en- 28- oic acid, 3 , 15 ,30- trihydroxy- urs- 12- en- 28- oic acid, 3, 4- seco- ursan- 4, 30- dihydroxy- 12- en- 3, 28- dioic acid, 从这些转化产图4 Arthrinium. sp 菌落形态和显微结构 A -菌落; B -菌丝 Fig. 4 Colony morphology and microstructure of Arthrinium. sp A - colony; B - mycelia
图5 内生菌转化反应的 TLC s -底物对照; 1 -转化粗提物; 2 -菌对照Fig. 5 TLC of biotransformation reaction s - control for substrate; 1 - crude of biotransformation product; 2 - control for strain 物的结构我们可以清晰地看出, 3 位的羟基基团可以氧化成羰基, 15 位可以引入 型的羟基,这在传统的化学转化中是很难实现的 除了环上发生羟基化反应外, 30 位的侧链也可以发生羟基化反应 有些产物还发生开环反应, A 环中 3 4 位的 C- C 单键打开, 4 位形成羟基, 而3 位氧化成羧基基团 在微生物转化中, 往往伴随着几种反应的同时发生内 生菌与宿主植物长期共生, 由于其特殊的生境可能导致某些特殊的酶系产生, 进而催化特殊的反应 3 讨论 内生菌在药用植物体内广泛存在, 由于其所处的生态环境多样性, 导致内生菌的种类多样性,其体内所含的酶系也往往比较特殊 利用生物转化的方法对已知天然活性成分进行结构修饰改造, 得到新的衍生物, 结合药理毒理实验对天然活性产物进行构效分析, 为寻找和开发新的高效低毒的化合物,提供了一条崭新的途径, 已成为新药开发与研究的重要手段[18] 本实验研究了药用植物内生菌的新的活性领域, 已经不仅仅局限于内生菌所产生的活性物质的研究 利用内生菌对天然产物乌苏酸进行生物转化也为其结构修饰提供了一定的研究基础,为进一步开发其产物类型和药理活性奠定了方法和技术 基础 REFERENCES [1] KONG Q K, DING A Y. Advances of study on endophytic bacte-ria as biologival control agents[J]. Journal of Shandong Agricul-tural University( Natural Science Edition) ( 山东农业大学学报,理学版) , 2001, 32 ( 2) : 256- 260. [2] HE R Q. Plant endophyte becomes one of hot topics in the current microbiological study in China[J]. Bull Microbiol( 微生物学通报) , 2009, 36( 1) : 1- 1. [3] QIAO Q M, CHENG M G, WANG C L. Endophytes of medicinalplants in the development of natural medicine [J]. Journal ofZhengzhou College of Animal Husbandry Engineering ( 郑州牧业工程高等专科学校学报) , 2008, 28( 1) : 24- 27. [4] CHEN Y J, ZHANG Z, WANG Y,et al. Screening endophyticfungus to produce taxol from Taxus yunnanensis[J]. Biotechnol-ogy ( 生物技术) , 2003, 2( 3) : 10- 11. [5] SHRESTHA K, STROBEL G A, SHRIVASTSVA S P,et al. Evi-dence for paclitaxel from three new endophytci fungi of Himalayanyew of Nepal[J]. Planta Med, 2001, 67( 4) : 374- 376. [6] SUN L J, LU Z X, BIE X M, et al. Isolation and identification ofan antimicrobial endophytic strain EJH- 2[J]. Chin J Microecol( 中国微生态学杂志) , 2006, 18( 1) : 23- 26. [7] DAI C C, YU B Y, XU Z L, et al. The screening and identifica-tion of endophytic fungi from four species of family euphorbiaceaeand the strains antibacterial activity[J]. Journal of Nanjing For-estry Universty ( Natural Sciences Edition) [南京林业大学学报( 自然科学版) ], 2006, 30( 1) : 79- 83. [8] JIANG D F, MA P, ZHANG L Q, et al. The studies of fungal pop-ulation and relationship between fungi and forming of dragon sblood resin in Dracaena cochinchnensis[J]. Acta Bot Yunnanica( 云南植物研究) , 1995, 17( 1) : 79- 82. [9] JIANG D F, MA P, ZHANG Y J, et al. Formation of blood resinin abiotic Dracaena cochinchinensis inoculated with Fusarium9568D[J]. Chin J Appl Ecol ( 应用生态学报) , 2003, 14( 3) :477- 478. [10] LIU C H, ZOU W X, LU H,et al. Antifungal activity of Artemisiaannua endophyte cultures against phytopathogenic fungi[J]. JBiotechnol, 2001, 88( 3) : 277- 282. [ 11] ZHANG B, SALITURO G, SZALKOWSKI D, et al. Discovery ofsmall molecule insulin with antidiabetic activity in mice[J]. Sci-ence, 1999, 284( 5416) : 974- 977. [ 12] HSU Y L, KUO P L, LIN C C, et al. Proliferative inhibition, cell-cycle dysregulation, and induction of apoptosis by ursolic acid inhuman nonsmall cell lung cancerA549 cell[J]. Life Sci, 2004,19 ( 75) : 2303- 2316. [ 13] HARMAND P O, DUVAL R, DELAGE C, et al. Ursolic acid in-duces apoptosis through mitochondrial intrinsic pathway andcaspase- 3 activation inM4Beu melanoma cells[J]. Int J Cancer,2005, 114( 1) : 1 -11.[ 14] CHATTOPADHYAY D, ARUNACHALAM G, MANDAL A B, etal. Antimicrobial and anti- inflammatory activity of folklore: Mall- otus peltatus leaf extract [J]. J Ethnopharmacol, 2002, 82 ( 2-3) : 229- 237. [ 15] MA C M, NAKAMURA N, MIYASHIRO H,et al. Inhibitory effectsof constituents from Cynomorium songaricum and related triterpenederivativeson HIV- 1 protease[J] . Chem Pharm Bull, 1999, 47( 2) :141 -145. [16] SARASWAT B, VISEN P K, AGARWAL D P. Ursolic acid isola-ted from eucalyptus tereticornis protects against ethanol toxicity inisolated rat hepatocytes[J]. Phytother Res, 2000, 14 ( 3) : 161-166. [ 17] JU J H, ZHOU L, LIN G, et al. Studies on constituents of triter-pene acids from Eriobot rya j aponica and their anti- inflammatoryand antitussive effects[J]. Chin Pharm J ( 中国药学杂志) ,2003, 38( 10) : 752- 757. [ 18] YU B Y. Biotransformation of natural bioactive compounds andthe development of creative drugs[J]. World Sci- tech R & D ( 世界科技研究与发展) , 1999, 21 ( 5) : 36- 39. |







 药用植物内生菌对乌苏酸(熊果酸)的微生物转化筛选
药用植物内生菌对乌苏酸(熊果酸)的微生物转化筛选