| 绿原酸的微波超声波联合提取及其抑菌作用 |
| 发布时间:2011-01-04 信息来源:admin 发布人:admin 点击次数:4147 |
绿原酸的微波超声波联合提取及其抑菌作用
摘 要:为了寻找更高效的绿原酸提取方法及进一步明确绿原酸的抑菌活性及抗菌谱,本文以金银花为材料,通过对稀醇回流法、超声波提取法、微波辅助提取法等方法的考察发现微波-超声波联合提取法的绿原酸提取率最高;正交实验得出其最佳工艺参数为:在250 W功率下微波预处理3次,30 s/次;再按料液比(v/v,1/20)加入70 %乙醇,在功率18 W下超声提取20 min,一次性提取率即达73%以上;各因素的影响大小分别为:超声功率>溶剂倍量>超声时间。抑菌研究表明,绿原酸对革兰氏阴性菌的抑菌活性比革兰氏阳性菌更强,绿原酸水溶液对志贺氏菌、沙门氏菌的最小抑菌浓度均为0.125 mg/ml,抑菌效果与0.1 mg/ml的卡那霉素的抑菌效果相当。
关键词:金银花;绿原酸;微波-超声波联合提取;抑菌活性 上禾生物 staherb
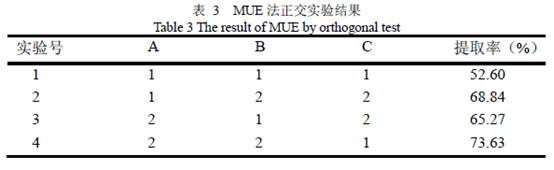
1. 引言 金银花(houneysuckle flowers)为忍冬科植物忍冬(Lonicera japonica Thunb)的干燥花蕾或初开的花。金银花的特征活性成分为绿原酸,具有抗菌、抗病毒、升高白细胞、免疫调节、抗肿瘤、降血压、降血脂等作用。Hideko M 等的研究结果认为, 绿原酸是很有希望的抗艾滋病毒(HIV)的先导化合物。鉴于绿原酸的巨大开发价值,国内外已纷纷开展绿原酸提取及其药理活性的相关研究,绿原酸的提取工艺也取得了一定的研究进展,但提取率低、能耗大、耗时长、工艺复杂等问题一直未能有效解决。微波、超声波提取作为新型的提取技术,具有被提取活性物质不被破坏,提取时间短等优点,在天然产物提取方面已得到广泛的应用,然而目前只有少量应用微波、超声波提取技术提取绿原酸的报道,且尚无将微波-超声波联用提取金银花中绿原酸的报道。目前虽已有一些关于绿原酸抑菌活性作用的研究报道,但绿原酸的抑菌作用机理及其抗菌谱尚不明了,尚无绿原酸关于志贺氏菌、沙门氏菌、李斯特菌等几种常见致病菌的抑菌活性报道,为此,本文以重庆金银花为原料,以绿原酸提取率为指标,采用UV光谱法、HPLC法定性定量分析方法,通过对70%乙醇回流提取法、超声波提取法、微波辅助提取法与微波-超声波联用法进行比较研究;并研究了绿原酸对志贺氏菌、沙门氏菌、李斯特菌的抑菌活性,以期优化绿原酸的提取工艺,明确绿原酸抗菌谱提供参考。 2. 材料与方法 2.1 材料、试剂与仪器 金银花取自重庆市秀山县,沙门氏菌、志贺氏菌、李斯特菌、金黄色葡萄球菌菌株为实验室保存。主要试剂:无水甲醇,冰乙酸为色谱纯;无水乙醇等购自重庆化学试剂公司,均为化学纯;绿原酸标准品购自Sigma公司。 主要实验仪器:超声波发生器(SONICS&MATERIALS,美国);微波炉(格兰仕,中 国);旋转蒸发仪(BUCHI,瑞士);紫外成相系统(Bio-Rad,美国);紫外可见光分光光 度仪(岛津UV-2450,日本);HPLC仪(岛津10AVP-10AT,日本)。 2.2 提取工艺: 2.2.1 稀醇回流法精密称取金银花粉末10 g,用70%乙醇按料液比1:8混合,在pH值3.0下60℃恒温振荡回流提取2次,2 h/次。将样品液真空减压抽滤,加水沉淀蛋白鞣质等杂质,用旋转蒸发仪浓缩至原体积1/4~1/5,低温冷藏备用。 2.2.2 超声波提取法(UE) 用70 %乙醇溶液将金银花干粉10 g 按液料比1:5 (v/v)预浸过夜,按料液比(v/v,1:8)加入70%乙醇溶液,调pH 3.0,超声(20 Hz)提取两次,30 min /次,下同2.2.1。 2.2.3 微波辅助提取法(ME 法) 用70%乙醇溶液将金银花干粉10 g 按液料比(1/5, v/v)预浸过夜,微波(250 W)打3 次,30 s/次;再按料液比(1/8, v/v)加入70%乙醇溶液调pH 3.0,60℃水浴回流提取两次,30 min/次,下同2.2.1。 2.2.4 微波-超声波联合提取法(MUE 法) 用70 %乙醇溶液将金银花干粉10g 按液料比(v/v,1:5)预浸过夜,在微波功率250 W 条件下预处理3 次,30 s/次;加入70%乙醇溶液按料液比(v/v,1:8),调pH 3.0,超声(20 Hz)提取两次,30 min /次,反应温度为常温,下同2.2.1。 2.3 MUE 法正交实验优化 选用L(23)因素水平表对MUE 法进行正交实验优化,见表1。
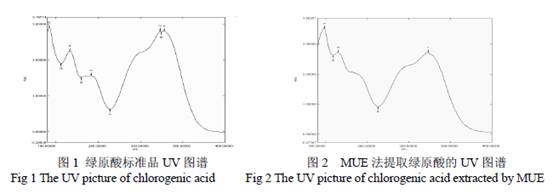
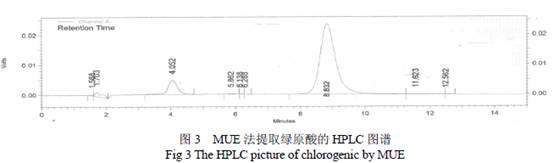
2.4 紫外光谱法(UV)分析 配制绿原酸(上禾生物)标准品溶液,用UV-2450 型紫外可见光分光光度计在200~400 nm 波长范围内扫峰,确定绿原酸标准品的最大吸收波长;再用50%的甲醇溶液将绿原酸标准品精密配制成0.2,0.5,0.75,1.0,1.25,1.5 μg/ml 6 个浓度的溶液,在最大吸收波长下测定其吸光值(A)。以浓度C(x 轴)对浓度吸光度A (y 轴)作图绘制UV 标准曲线,得到标准曲线回归方程。同法定溶各方法提取物及纯化物,制成待测样品,测定吸光值,通过标准曲线回归方程计算各终产物中绿原酸含量。 2.5 高效液相色谱(HPLC)分析 采用外标法对待测样品进行定性分析。色谱柱: ZOBAX SB(150 mm×4.6 mm,5 μm) ;流动相:甲醇:超纯水:冰乙酸(18:81:1,v/v);流速:1 mL·min- 1;检测波长: 紫外扫描的最大吸收波长;柱温:30 ℃;进样量:20 μL。用50 %的甲醇溶液将绿原酸(上禾生物)标准品溶液精密配制成0.1,0.3,0.5,0.7,1.0,1.3 μg/ml 6 个浓度的溶液进样检测。以浓度C(x 轴)对峰面积V(y 轴)作图,得到标准曲线回归方程。同法定溶各方法提取物及纯化物,制成待测样品,进样测定峰面积,通过标准曲线回归方程计算各终产物中绿原酸含量。 2.6 抑菌实验 采用超净工作台无菌操作;取10 ml 琼脂培养基于直径为9 cm 的无菌培养皿中,铺匀,凝固后,取50 μl含有活菌数为106~108/ml的菌液均匀涂布到培养皿中,放入直径为5 mm的滤纸片;分别在滤纸片上滴加20 μl用纯水配置的(1 mg/ml,0.5 mg/ml,0.25 mg/ml,0.125mg/ml,0.0625 mg/ml )5个浓度梯度的绿原酸提取物及其纯品溶液;以浓度为0.1 mg/ml的卡那霉素作阳性对照,用超纯水作空白对照;37℃恒温培养箱培养24~48 h后,观察抑菌圈的大小和透明度,恰好没有抑菌圈出现的培养皿所用的溶液浓度为最小抑菌浓度(MIC)。三次重复。 3. 结果与分析 3.1 金银花提取物的鉴定 3.1.1 金银花提取物的UV 鉴定 通过UV 扫描测定绿原酸(上禾生物)标准品的最大吸收波长约为327nm(图1),故确定该波长为UV 及HPLC 检测波长。提取终产物出现最大吸收峰的波长及峰形均与标准品一致,因此,可初步认为该终产物含绿原酸(见图2,3)。
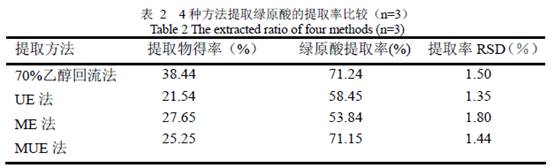
3.1.2 金银花提取物的HPLC 测定 经实验优化,HPLC 分析参数为:色谱柱ZOBAX SB( 150 mm ×4. 6mm, 5μm) ;流动相为甲醇:水:乙酸(18:81:1,v/v) ;流速:1 mL·min- 1 ;检测波长:327 nm;柱温:30 ℃;进样量:20 μL。在此条件下,样品中绿原酸与相邻成分达到基线分离(见图3)。根据绿原酸标准品的HPLC 检测结果,以浓度C(x 轴)对峰面积V(y 轴)作图,得到标准曲线回归方程为:y = 52446 x-2573,R=0.9931;在1~13 μg/ml 范围内线性关系良好。采用外标法对提取的绿原酸进行确认,在保留时间8.832 min 检测到的物质为绿原酸;同法测得金银花生药绿原酸含量为3.3 %(n=5,RSD=2.0 %),回收率98 %。
3.2 4 种提取方法对绿原酸含量的影响 由HPLC 法测定各提取法终产物中绿原酸的含量,结果见表2。
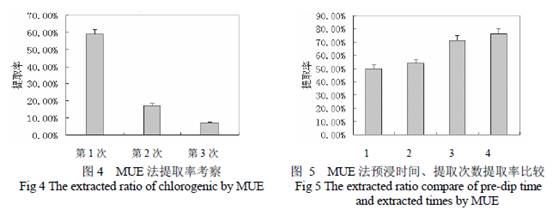
由表2 可以看出,用MUE 法提取绿原酸的提取率与70 %乙醇回流法相当,高于单独的超声法和微波辅助提取法;采用MUE 法提取的提取物中绿原酸含量最高,由图3 可见MUE 法粗提物有1 个杂峰;而回流法提取物中杂质含量较高,其HPLC 图谱有4 个杂峰。综合考虑以上因素,各提取法中MUE 法提取物中绿原酸含量最高引入杂质最少,反应条件较回流法温和且耗时更短,常温短时间提取即可达到与回流法相当的绿原酸提取率。 由图4 可以看出,采用MUE 法提取效率高,在第1、2 次提取后其提取率已经达到80 %以上;由图5 可以看出相同溶剂量情况下2 次提取较1 次提取的提取率提高了20 %以上,但2 次提取缺点是增加了操作步骤,可以考虑适当加大溶剂量一次提取;另外,微
注:图5 中1,2 为14 倍剂量一次提取;3, 4 为两次提取(v/v,1/8,1/6);1,3 为预浸1 h;2,4 为预浸2 h 波破壁前预浸2 h 较1 h 提取效率高了5 %以上,由此结合微波的工作原理可以推断预浸过程中预浸2 h 较1 h 水分进入样品更充分,更利于微波发挥作用。综合考虑提取时间,提取流程复杂程度,实际经济价值等因素,最终确定将原料预浸过夜(不耽误正常工作时间),一次性提取作为MUE 法正交实验的参数。 3.3 MUE 法提取条件优化 为了优化MUE 法的提取条件,本研究采用了L(23)正交实验,结果见表3。
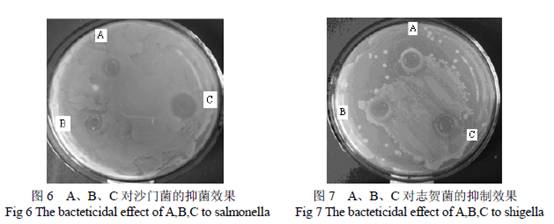
由表3(方差分析表略)结果得出最佳工艺为A2B2C1,即20 倍量,18 W,20 min。各因素的影响大小顺序为B>A>C,即超声功率>溶剂倍量>超声时间。在此条件下一次提取率既可以达到73.63 %,明显优于传统提取法。 3.4 绿原酸提取物抑菌活性 比较绿原酸标准品和金银花中绿原酸提取纯化物对四种菌的抑制效果后发现二者抑菌效果相当(图8,图9),抑菌圈直径从大到小分别为:志贺菌、沙门菌、李斯特菌、金葡菌;对志贺菌、沙门菌的MIC 均为0.125 mg/ml,对金葡菌的MIC 为1 mg/ml,对李斯特菌的MIC 为0.5 mg/ml(表4)。
绿原酸标品(图中A)、金银花绿原酸提取物(图中B)、卡那霉素(图中C)的抑菌活性对比见图6,图7。由图可以看出绿原酸标品(1 mg/ml)和金银花中绿原酸提取物(1 mg/ml)对志贺菌、沙门菌二种菌的抑制效果一致,且与卡那霉素0.1 mg/ml 所产生的抑菌效果相当。
4. 结论 本文经提取方法对比,MUE法提取率显著高于单独采用ME法或UE法。王宏军[13]等人采用超声波-索氏联合提取法(U+S法)提取终产物中绿原酸含量也显著高于U法和S法,而MUE法的提取时间较U+S法大大缩短,且提取效率更高,估计是在微波短时多次破壁和超声波破壁双重作用下细胞破壁更彻底,更加利于绿原酸溶出,且在温和提取条件下绿原酸结构得到了更好的保护;正交实验结果显示,超声功率对提取率影响最显著,说明有必要进一步研究超声功率与细胞破壁及提取率关系;综合考虑上述因素可以推测,提高细胞破壁效率及保护绿原酸结构是提高绿原酸提取率的关键,有必要在这一方面做更深入和全面的研究。 在绿原酸含量的检测中,紫外分光光度法所测结果与高效液相法所测结果相比偏差较大,但趋势相同,这与乌兰[14]等人的研究结果一致,故绿原酸的定量应采用HPLC 法为好;但将紫外分光光度法用于前期的提取工艺比较筛选既有效也可以节约实验时间和成本。 本文在抑菌实验中采用滤纸片代替牛津杯[14]也取得了满意的效果,且简单易操作。绿原酸标品和金银花中绿原酸提取物对志贺菌、沙门菌的抑菌效果较对李斯特菌和金葡菌强;对这两种菌的MIC与卡那霉素的常用抑菌MIC(0.1 mg/ml)相当;对金葡菌的MIC 为1 mg/ml与张红峰等[19]报道的MIC(0.8 mg/ml)基本一致,其原因可能是使用方法的差异。志贺菌、沙门菌均为革兰氏阴性菌,李斯特菌和金葡菌均为革兰氏阳性菌,推测绿原酸对革兰氏阴性菌的抑制活性可能更强。在致病菌对对抗生素耐药性普遍增强的今天,将绿原酸作为代替抗生素的抑菌活性成分具有很好的开发价值。
参考文献 [1] 张鞍灵,马琼,高锦明,等.绿原酸及其类似物与生物活性[J].中草药,2001,32(2):173-176 [2] 于生兰,张龙,孙玲.金银花的研究进展[J].时珍国医国药,2002,13(8):498-500 [3] M.Hideko, O.Motoyo. Absorption, metabolism and biological activities of chlorogenic acids and related compounds.Studies in Natural Product Chemistry, 2001, 25(6) :919-953 [4] H.Li, B.Chen, S.Yao.Application of ultrasonic technique for extracting chlorogenicacid from Eucommia ulmodies leaves[J]. (E. ulmodies).Ultrasonics Sonochemistry, 2005,12 :295–300 [5] C .Hui Li, B .Bo Chen.Focused microwave-assisted solvent extraction and HPLC determination of effective constituents in Eucommia ulmodies leaves (E. ulmodies)[J]. Talanta , 2004,63:659–665 [6] S.Dagmar, M.David. Combined microwave-assisted isolation and solid-phase purification procedures prior to the chromatographic determination of phenolic compounds in plant materials .Analytical Chemical Acta[J],2004,513: 435–444 [7] 尹波,王科军.超声波法提取金银花中的绿原酸[J].林产化工通讯,2005,39 卷(第1 期):14 -16 [8] 郝瑞然,韦藤幼.减压内部沸腾法提取金银花中的绿原酸[J]. 广西科学,2006年,第13卷(第1期):43-45 [9] 李剑敏,卫兵,陈志红.微波强化提取杜仲叶中绿原酸的工艺研究[J].应用化工, 2006 年第35 卷(第4期):243-245 [10] 颜流水,郑鄂香,丁军军,等.藜蒿中绿原酸的密闭微波辅助萃取研究[J].食品与发酵工业,2005 年,第31 卷(第12 期) :137-139 [11] 郭振库,金钦汉,范国强,等.微波帮助提取中药金银花中有效成分的研究[J]. 中国中药杂志, 2002 年,第27 卷(第3 期):189-192 [12] 王宏军,吴国娟,孙 健,等.绿原酸的药效学研究.中兽医学杂志[J].2005 年第5 期(总126 期):7-11 [13] 王宏军,吴国娟,李焕荣,等.金银花中绿原酸提取方法的筛选及其抑菌作用[J]. 北京农学院学报. 2003 年,第18 卷(第4 期):262-265 [14] 乌兰,张泽生.金银花中绿原酸的提取及检测[J].食品科学.2005,第26 卷(第6 期):130~134 [15] 张泽生,乌 兰,金银花中绿原酸的体外抑菌和抗氧化性的研究[J].天津科技大学学报. 2005 年6 月.第20卷(第2 期):6-8 [16] 武雪芬,白 雁.金银花叶药用成分的提取及抑菌试验研究[J].中成药.2001 年6 月.第23 卷(第6期):448-449 [17] 蔡霄英,刘永乐.金银花中绿原酸的分离与测定新方法[J].食品科技,2003 年, 第5 期:104-106 [18] 周志锦.金银花及其制剂中绿原酸的含量测定[J].浙江中医学院学报,2002 年,第26 卷(第4 期):82 [19] 张红锋,白艳军,蓝宇淑,等.中药金银花提取物的体外抑菌作用[J].华东师范大学学报(自然科学版),2000年,(第1 期):107 – 110
产品链接:
杜仲提取物 绿原酸 金银花提取物 苦杏仁苷 枇杷叶提取物-熊果酸 大花紫薇提取物-科罗索酸
上禾生物 专注植提 精于高纯 基于您对天然产物需求持续创新 |







 绿原酸的微波超声波联合提取及其抑菌作用
绿原酸的微波超声波联合提取及其抑菌作用